2型糖尿病是当前非常常见的一种代谢疾病。截止目前,全球约有3.7亿人受这一疾病所困扰。此外,根据预测模型,这一数字在2030年的时候还要再翻一番【1】。尽管已经开发出一些降糖药物,比如我们熟知的胰岛素、二甲双胍,但对于越来越庞大的2型糖尿病患者人群而言,仅有的这些降糖药物显然不能满足需求,因此科学家们一直致力于寻找其他有效的降糖新药。
白介素-6(IL-6)和睫状神经营养因子(CNTF)在小鼠和人中均被报道可以控制体重并且增强胰岛素的敏感性【2,3】。但遗憾的是,IL-6本身是促炎的,因此限制了其药用价值。而对于CNTF而言,尽管人源的CNTF—Axokine已经被用于治疗肌萎缩性侧束硬化(amyotrophic lateral sclerosis)的临床试验,但人们发现在治疗过程中体内会产生相应的抗体【4】,由于担心带来的副作用,所以这项临床试验也被叫停了。
2019年9月26日,来自澳大利亚Garvan医学研究机构的Mark A. Febbraio教授的科研团队在Nature上发表题为Treatment of type 2 diabetes with the designer cytokine IC7Fc的研究,他们另辟蹊径,通过对IL-6和CNTF进行“取长补短”得到了一个新的人工组装蛋白—IC7Fc,并且有望用于治疗2型糖尿病。

IL-6-IL-6R复合体会结合两个gp130受体形成同型二聚体,而CNTF-CNTFR复合体会会同时结合gp130受体和LIFR受体形成异源二聚体。考虑到这两个蛋白发挥降糖功能的时候都有其局限性,作者猜测是否可以扬长避短,组装一个新的蛋白能够兼具这两个蛋白的功能而消除其负作用。于是作者将CNTF结合LIFR的结构域替换到IL-6上,形成一个新的人工合成蛋白IC7(见下图),再将免疫球蛋白G的Fc结构域与IC7进行融合,最终得到一个与CNTF类似但是IL-6R依赖的细胞因子-- IC7Fc。
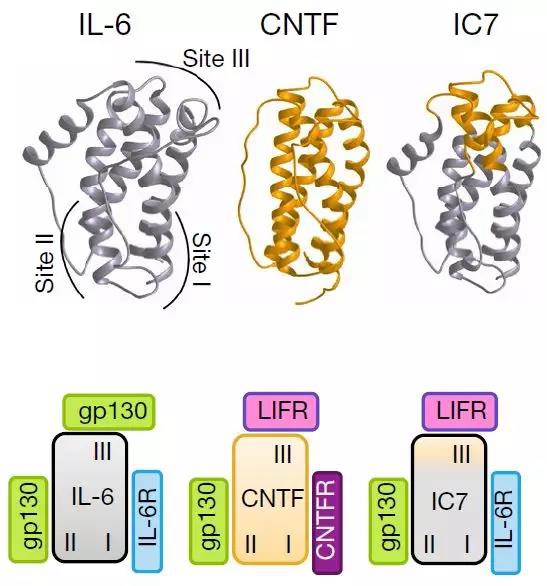
作者首先对IC7Fc的生物活性进行验证。体内和体外实验表明,IC7Fc不仅可以与IL-6竞争结合IL-6R,并且可以激活由IL-6诱导的Stat3磷酸化。更有意思的是,由于对IC7Fc进行过结构改造,所以IC7Fc被释放到血液中后不会像IL-6那样快速被gp130受体所中和,所以可以发挥更长效的作用。紧接着,作者在高脂饲喂诱导的肥胖(DIO)小鼠模型中对IC7Fc功能进行探究,结果表明:腹腔注射IC7Fc显著降低小鼠体重和脂肪重量,且不会改变瘦肉的重量。此外,IC7Fc可以降低小鼠空腹血糖并增强其糖耐受能力。这些结果表明IC7Fc的确可以改善肥胖小鼠的各项生理指标。
那么IC7Fc是如何在体内发挥功能呢?通过实验,作者发现IC7Fc的功能主要通过影响以下三种代谢途径来实现。第一,IC7Fc可以增强AMPK活性促进DIO小鼠的脂肪酸氧化从而减少脂肪的累积,并在这一过程中特异性地激活肌肉组织中Hippo通路,维持肌肉重量稳定。第二,IC7Fc可以促进胰岛β细胞分泌胰岛素降低血糖。第三,IC7Fc还可以部分通过影响肠降血糖素(incretins)分泌来协助胰岛素稳定血糖。
最后,作者构建了IC7Fc过表达的转基因小鼠模型对其功能进行进一步验证。结果表明实验组小鼠体重、脂肪重量、空腹血糖以及胰岛素浓度等各项指标均优于对照组小鼠,与直接腹腔注射IC7Fc小鼠表型类似。
考虑到IC7Fc未来有希望成为一款治疗2型糖尿病的药物,作者对其在体内的安全性进行了评估。作者以与人亲缘很近的长尾猕猴作为实验对象,在接受IC7Fc注射之后并没有观察到有任何副作用产生。此外,作者也验证了IC7Fc也不会在体内激活炎症反应。
综上,作者利用生物工程的技术对IL-6和CNTF这两个细胞因子进行“取长补短”,创造了一个全新的融合蛋白—IC7Fc,并在小鼠体内取得了理想的实验预期。重要的是,在灵长类动物中其安全性已经得到了初步验证,当前,作者正在积极推进IC7Fc临床I期实验。可以看出,作者对于IC7Fc未来成为一款治疗2型糖尿病的新药抱有极大的信心。
原文链接:
https://doi.org/10.1038/s41586-019-1601-9
参考文献
1. Danaei, G. et al. National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants.Lancet378, 31–40 (2011).
2. Carey, A. L. et al. Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase.Diabetes55, 2688–2697 (2006).
3. Watt, M. J. et al. CNTF reverses obesity-induced insulin resistance by activating skeletal muscle AMPK.Nat. Med.12, 541–548 (2006).
4. Ettinger, M. P. et al. Recombinant variant of ciliary neurotrophic factor for weight loss in obese adults: a randomized, dose-ranging study.J. Am. Med. Assoc.289,1826–1832 (2003).
