自基因组编辑技术横空出世以来,人们就对它寄予了无限厚望。利用该技术治疗疾病、探索生命奥秘的各种研究也纷纷登场。
而能够精确修改单个碱基的碱基编辑器(BE)的诞生,又将这种渴望推上了一个新的高度。
然而就在今天,两个中国团队,中科院神经所杨辉领导的团队和遗传与发育所高彩霞领导的团队,在《科学》杂志上背靠背发表两篇研究论文,向这个领域投下了重磅炸弹!
杨辉团队发现,一种碱基编辑器CBE(胞嘧啶碱基编辑器),会在小鼠胚胎细胞中制造了大量的非目标编辑,平均每个细胞出现了283个单碱基突变(SNVs),是正常情况的20倍[1]。这个结果得到高彩霞团队的支持,他们在水稻中也发现了碱基编辑器的严重脱靶现象,CBE在水稻全基因组上制造了大量SNVs[2]。
这两项研究,首次将碱基编辑器的阿克琉斯之踵,清晰地展现在了人们眼前。这足以引起科学家的重视,警惕基因组编辑技术,尤其是碱基编辑器研究和应用中的隐患。

左:高彩霞 右:杨辉说到基因编辑技术,人们最先想到的一定是现在大热的CRISPR/Cas9系统。
但是,CRISPR/Cas9系统也面临着一个无法回避的问题,那就是它编辑的结果不够精确,甚至不可控制。
CRISPR/Cas9系统工作时,必须要先在双链DNA的目标位置,剪上一刀(两条链都剪断),然后让细胞自己去修复。修复的时候有出错的可能,这样就会引入突变,实现了对基因组目标序列的修改[3]。
可是,这些突变往往是不可控的,碱基多几个、少几个(Indel)或者换几个,都有可能。也就是说CRISPR/Cas9系统,并不能让你把基因想怎么改就怎么改。
如果你只需要把某个基因破坏掉,CRISPR/Cas9系统是可以胜任的。
但是想要对某个位点进行精确修改,它就很难做到了,如治疗地中海贫血病。而这类点突变造成的遗传病,又占了人类所有遗传病的一大半。此外,还有其他与点突变有关的疾病,如癌症(p53突变)等,CRISPR/Cas9系统基本上是束手无策的。
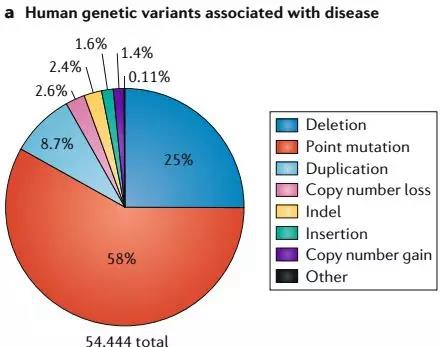
不同变异造成的遗传病这个时候,碱基编辑器(Base editor, BE)出现了。
2016年,华人科学家刘如谦博士(David Liu)对CRISPR/Cas9系统进行了修改,将剪刀换成了涂改器,首次将DNA上的C改成了T,称之为胞嘧啶碱基编辑器(CBE)[4]。
2017年,他又再接再厉,成功发明了能将A改为G的碱基编辑器,称为腺嘌呤碱基编辑器(ABE)[5]。
有了CBE和ABE的组合,我们就能任意修改DNA上的单个碱基了(利用碱基互补原则)。
听起来很完美,可问题却还是存在。
CRISPR/Cas9系统有时会出现严重的脱靶问题,大家都知道,我们也称曾做过报道。
CRISPR/Cas9系统脱靶的原因,在于它的Cas9酶(也就是剪刀)有时候会不遵循gRNA的引导,在DNA的非目标区域乱剪一气,由此造成脱靶。
把剪刀换成涂改器就安全了吗?
还是让实验数据来说话。
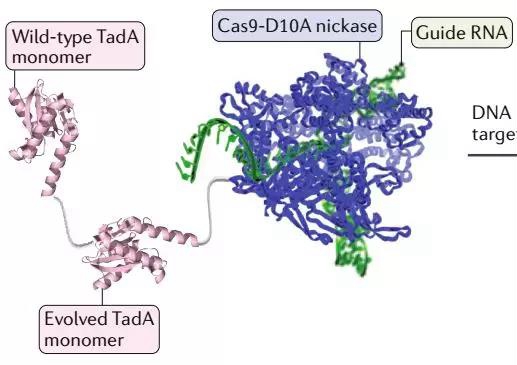
一种碱基编辑器的结构
中科院神经所的杨辉研究员带领一个联合团队,对碱基编辑器在动物基因组上的脱靶情况,进行了检测。他们对CRISPR/Cas9系统、CBE、ABE这几种基因编辑技术进行了比较。
为了避免自然突变造成的误差,研究人员发明一种叫GOTI的技术。这个技术是将小鼠二细胞胚胎进行编辑,被编辑过的细胞会带荧光,而未编辑的细胞不带荧光。
然后让这个胚胎继续发育,等到14.5天后,胚胎拥有了足够的细胞,将其消化为单细胞。用流式细胞仪将编辑过或未编辑过的细胞分开。编辑过的细胞和未编辑过的细胞都来自同一个胚胎,就可以相互对照,最大程度地消除自发突变的影响。
对这些细胞进行单细胞全基因组测序,比较各个编辑器引起的单碱基突变(SNVs)发现,CBE(BE 3.0)编辑过的胚胎上平均拥有283个的单碱基突变,其中90%是C到T的突变(CBE的能力),是阴性对照(自发突变)的20倍!而CRISPR/Cas9、ABE等系统造成的突变数量,和自发突变类似。
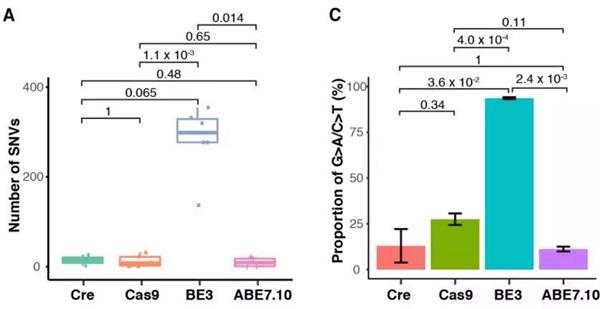
CBE(BE3)引起的点突变远多于其他
而且,CBE造成的突变中,1个突变出现在了原癌基因上,而13个突变出现在了抑癌基因上。CBE脱靶造成的威胁是可见的。
此外,他们还检测了基因组上Indel 形式的脱靶(主要是CRISPR/Cas9系统引起的),发现每个细胞平均只有0-4个Indel。CRISPR/Cas9系统引起的脱靶概率,并没有人们担忧的那么高。
高彩霞研究员实验室在水稻中也发现,CBE,而不是ABE会在全基因组上引发过多的突变。而且无论加不加gRNA进行引导,突变都会出现。
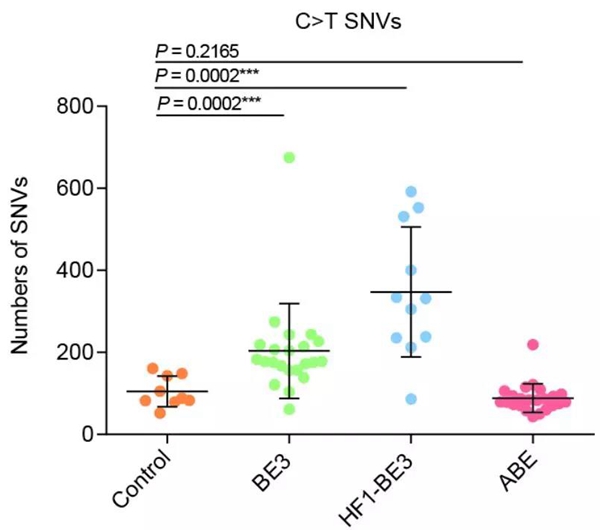
两种CBE(BE3)引起的突变明显更多
这两个独立进行的实验,分别在不同的模式物种中,得到了一致的结果。不得不引发人们对碱基编辑器脱靶效应的深思。
作为碱基编辑器的发明人,刘如谦博士表示,总的来说,这些脱靶仍很罕见,不太可能影响实验室对该技术的使用。但是,这些足以让任何打算在病人身上使用这项技术的人感到担忧。
而其他学者进一步表示,要深入探索造成突变的原因,进而加以改进。
韩国著名CRISPR技术研究者,Jin-Soo Kim教授说道“这两篇论文非常有趣,也非常重要。现在重要的是确定哪些成分引起了这些额外的突变,以及如何减少或避免它们。”[6]
ABE与CBE的差异就在于所带的涂改器(酶)不一样,因此也造成了脱靶结果不一样。这也为科学家们提供了观察和改进的窗口。
事实上,很多科学家并没有对这个消息抱以悲观的态度,这也不会扑灭他们研究的热情。很多实验室已经重新启程。
