相分离在膜受体及其下游信号转导通路中常有发生。以T细胞活化过程为例,TCR被Src家族激酶磷酸化后,招募胞内酪氨酸激酶ZAP70,后者磷酸化骨架蛋白上T细胞活化linker(LAT)的酪氨酸位点。磷酸化后的LAT可与接头蛋白Grb2的SH2/SH3结构域、GEF蛋白的脯氨酸富含域形成互作网络,发生相分离。2016年,著名的Ronald Vale(就是那位研究生期间打破科研记录一年发表4篇一作cell,26岁拿到PhD,42岁成为双院院士,研究分子马达的高富帅)实验室发现T细胞信号转导的过程中TCR磷酸化可诱导下游蛋白形成液液相分离,并最终促进肌动蛋白丝(actinfilament)的形成;这一研究首次阐明了相分离对信号转导有促进作用。
随着相分离领域的发展,众多体外实验逐步揭示相分离的发生主要有两种机制:一是蛋白内部的无序区自发形成相分离;二是蛋白间通过多价的相互作用,形成稳定的互作网络,从而发生相分离。那么,膜受体信号转导中的相分离究竟通过哪种机制发生,这一过程发生的化学计量学依据为何,相分离具体如何调控信号转导,其意义何为,这些问题目前仍不清楚。近日,Science杂志背靠背发表了来自UCB和UTSW的两个实验室对相分离调控细胞信号转导的化学计量学研究。


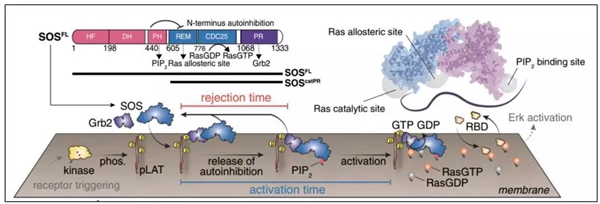
在UCB Jay T.Groves教授团队的研究中,研究者对(pY)LAT-Grb2-SOS信号通路中的SOS蛋白在TCR磷酸化以后是如何被招募到膜上、并从活性抑制状态中激活的过程进行了详尽的分析。SOS蛋白由N端histone fold、Dbl同源结构域、Pleckstrin同源结构域,C端PR(脯氨酸富含域),和催化活性中心REM(Ras交换motif)、CDC25结构域构成。其C端PR与接头蛋白Grb2的SH3结构域互作,N端则通过分子内及分子间的互作阻挡活性中心发挥作用。研究者通过inteinligation得到了全长的SOS蛋白,通过单分子实验发现,SOS在被Grb2招募到细胞膜后有两种形式:招募后活化(activation)和招募后排斥(rejection)。两种形式分别对应着不同的结构基础:Activation形式的SOS蛋白通过与PIP2等阴离子脂质互作,开放活性中心,从而激活下游Ras蛋白;而Rejction形式的SOS蛋白则迅速游离开细胞膜,保持活性抑制状态。多个单分子实验的统计结果显示,Activation形式的SOS蛋白从被招募到活化所需的activation time呈先升后降的gamma分布而非指数分布,提示SOS蛋白的活化过程存在至少一个限速步骤。研究者通过化学计量学推算对这一实验结果进行了理论验证,当SOS蛋白活化需经历一个限速步骤时,其activation time的表达公示为
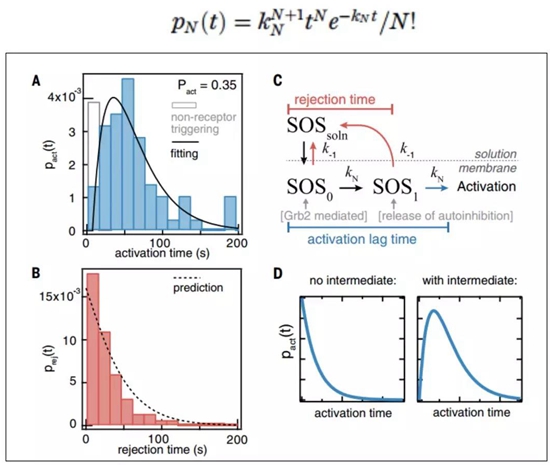
函数图像则如图D。由于SOS蛋白的活化主要是活性中心抑制状态到活性中心开放状态的转变,影响这一转变的关键分子有接头蛋白Grb2、SOS蛋白N端结构域和PIP2,研究者分别探究了这三者对于activation time的影响。结果发现,Grb2和SOS蛋白N端结构域是维持activationtime gamma分布的关键,两者通过影响SOS蛋白在膜上的驻留时间(dwell time)而维持限速步骤的存在,其具体机制则正是相分离。具体来说,SOS蛋白的PR结构域可与多个Grb2分子相互作用,驻留时间较长(4-6s)的SOS蛋白通过多个Grb2分子与至少两个LAT分子形成互作网络。在给定LAT及Grb2浓度的情况下,随着SOS蛋白PR结构域浓度的增加,可观察到相分离的形成。通过相分离而长时间驻留在膜上的SOS蛋白增加了与PIP2接触并活化的几率,相分离中每个SOS分子可4倍激活下游的Ras蛋白。而与单个Grb2分子互作的SOS蛋白在膜上的驻留时间则不到1s,其激活概率大大降低。
相分离调控SOS蛋白的膜驻留时间从而影响SOS蛋白的活化,这一限速步骤在化学计量学中被称为“动力学校正”(kineticproofreading),其主要意义为防止个别被偶然激活的上游信使分子大规模激活下游信号通路。除SOS蛋白以外,许多膜信号转导通路相关蛋白也表现出相似的机制,如小G蛋白Rho家族的鸟苷酸交换因子Vav蛋白,Raf蛋白,PI3K,诱导性T细胞激酶和起始肌动蛋白成核的Arp2/3复合物。UTSW Michael K.Rosen教授团队的研究即对Nephrin-Nck-N-WASP信号通路中的相分离现象进行了描绘。
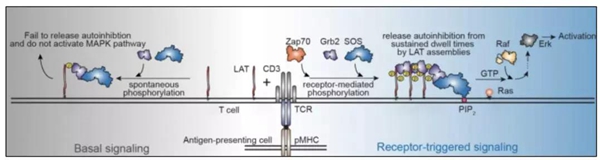
Michael K.Rosen教授早先报道了肾足细胞、活化的T细胞膜信号转导过程中存在相分离现象。这一相分离现象起始于在上游信号刺激下跨膜蛋白nephrin/LAT位于胞浆内的无序端被酪氨酸激酶磷酸化,磷酸化的酪氨酸位点可与适配蛋白的SH2、SH3、PRM结构域多价互作,最终形成微米级的相分离液滴。这两条信号通路的相分离能够特异性上调适配蛋白Nck及其配体N-WASP和actin成核因子Arp2/3复合物的活性,最终促进肌动蛋白成丝,而其具体如何上调复合物的活性尚不得而知。
研究者首先通过单分子实验证实pNephrin、Nck、N-WASP分子能够在体外自发形成液液相分离,且相分离内部肌动蛋白成丝的净能力(除去蛋白浓度的影响)比游离状态下肌动蛋白成丝的能力高14倍。肌动蛋白成丝的过程起始于Arp2/3:WASP2:Actin2复合物组装成为“母体”肌动蛋白丝,而后WASP从复合物中解聚、Arp2/3复合物不可逆的结合在“母体”肌动蛋白丝上,并开始“子代”肌动蛋白丝的装配。由于WASP的结合是这一过程中的主要限速步骤,研究者试图探究N-WASP在细胞膜上的驻留时间是否是影响其活性的主要因素之一。
首先,N-WASP是通过PRM与Nck的SH3结构域互作,从而连接到跨膜蛋白Nephrin的pTyr位点上的,其膜上驻留时间主要受到Nck浓度的影响。但此影响并非完全线性:当Nephrin的pTyr位点被Nck的SH3结构域饱和时,此互作网络最为稳固,N-WASP在膜上的驻留时间最长。其次,单分子实验证实,当N-WASP直接结合在细胞膜上时,其促进肌动蛋白成丝的能力是通过Nck间接结合在细胞膜上时的40倍余。最后,actin成丝的能力与nephrin-Nck-N-WASP的浓度呈现相似的非线性关系,而与WASP的膜上驻留时间则呈线性正相关。
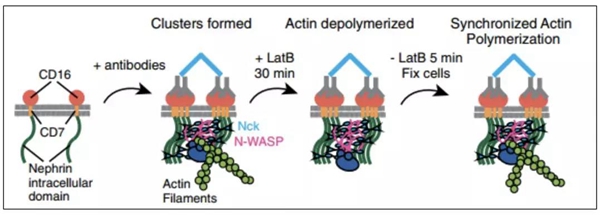
至此,在肾足细胞的膜信号转导过程中,pNephrin-Nck-N-WASP通过多价的相互作用形成相分离,而相分离的程度则受分子间相对浓度调节。液液相分离通过增加N-WASP的膜上驻留时间,显著上调N-WASP的活性,增强其通过Arp2/3复合物促进肌动蛋白成丝的能力。这一机制既抑制了上游通路低活跃水平下干扰信号对下游信号通路的大规模激活,又保证了高活跃水平时对下游信号通路的精细调节,因此在膜受体信号转导中尤为重要,并成为液液相分离的又一重要生物学功能。
